协会服务热线
010-6226-7180
第二阶段:从2005年版《中国药典》开始,药用辅料改为在二部中单独列出,称为“正文品种第二部分”,更便于检索查阅;该版药典共收载73个药用辅料标准。2010年版《中国药典》新增62个药用辅料标准,总数扩增到132个;该版还首次收载了药用辅料的通则(附录II),扩充了药用辅料的药典标准体系。
第三阶段:自2015年版《中国药典》,药用辅料标准与通则类标准合并单独形成了《中国药典》第四部,新增138个药用辅料标准,总数扩增到270个;并首次收载了9601<药用辅料功能性指标研究指导原则>,强化了药用辅料功能性相关指标在标准体系中的地位[1]。本版药典继续扩大药用辅料品种标准的收载,新增65个,修订212个(有实质修订的116个,仅文字规范的96个);新增药用辅料指导原则2个,修订药用辅料通则和指导原则各1个。所列数据表明,本版药典的药用辅料标准体系更加完备。
1.2 药包材标准
1.2.1 我国药包材标准概况
我国现行的药包材标准比较多元化,既包括《中国药典》和国外药典,也包括2015年版《国家药包材标准》、执行注册审批制时产生的国家标准和企业内控标准等。
1.2.2 《中国药典》药包材标准的收载情况
在2015年版《中国药典》(第十版)中首次收载了9621<药包材通用要求指导原则>和9622<药用玻璃材料和容器指导原则>两个指导原则,开启了药包材标准纳入《中国药典》的序幕,也强化了对药包材及其重要门类玻璃材料的总体要求。
基于对药包材标准体系的进一步研究,按照“总体规划,分步推进”的原则,在本版药典中加强了药包材通用检测方法的收载,新增通用检测方法16个,进一步扩充了药典药包材标准体系,为后续药包材标准体系的整体完善奠定了基础。
2 本版药典药用辅料和药包材的标准体系
2.1 药用辅料的标准体系
2.1.1 三位一体结构更加清晰
本版药典药用辅料标准由品种正文及其引用的凡例、通用技术要求共同构成。在药典编制中特别注重了四部凡例、相关通用技术要求与各品种正文的衔接,做到三者“各司其职”。凡例是为正确使用《中国药典》进行质量检验和检定的基本原则,故将上版四部凡例中药用辅料应符合GMP及单独审批等已与现行的原辅包关联审评审批制度不符的内容删去,以便与现行管理制度及法规相匹配。将上版四部凡例二十二条中关于药用辅料生产和使用的具体规定归入通则0251<药用辅料>中,以使四部凡例内容更聚焦于药用辅料质量检验和检定的共性问题。在本版药典四部凡例的正文内容、名称与编排、来源与制法、检查项、含量测定项、含量限度范围、类别等章节突出了药用辅料的特点。作为《中国药典》四部的总纲和说明,本版药典四部凡例中明确规定“制剂生产使用的药用辅料,应符合相关法律、法规、部门规章和规范性文件,以及本版药典通则0251<药用辅料>的有关要求”,由此确定了通则0251的强制执行性。
通用技术要求包括《中国药典》收载的通则、指导原则等;通则主要包括制剂通则、其他通则、通用检测方法。指导原则系为规范药典执行,指导药品标准制定和修订,提高药品质量控制水平所规定的非强制性、推荐性技术要求。本版药典收载的药用辅料通用技术要求包括通则0251<药用辅料>,9601<药用辅料功能性相关指标指导原则>(修订)、9602<动物源药用辅料指导原则>(新增)和9603<预混与共处理药用辅料质量控制指导原则>(新增)3个指导原则以及相关的通用检测方法。本版药典药用辅料通用技术要求结构图见图1。
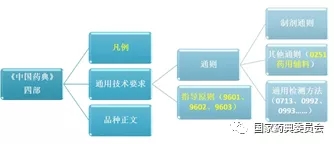
图1 2020年版《中国药典》药用辅料通用技术要求结构图
Fig.1 The structure chart on general technical requirements of pharmaceutical excipients in 2020 edition of Chinese Pharmacopoeia
2.1.2 药用辅料通则强化药典药用辅料标准定位
根据原辅包与制剂关联审评审批的制度导向,本版药典通则0251<药用辅料>中特别强调了在药品制剂研发和上市后变更研究中,对药用辅料的选用应以制剂质量为中心,以满足制剂的质量要求和设计目标为依据,加强药用辅料的适用性研究。适用性研究应充分考虑药用辅料的来源、工艺,及其制备制剂的特点、给药途径、使用人群和使用剂量等相关因素的影响。
基于上述理念,本版药典通则0251<药用辅料>中特别说明了《中国药典》药用辅料标准的定位。①权威性。《中华人民共和国药品管理法》第二十八条规定:国务院药品监督管理部门颁布的《中华人民共和国药典》和药品标准为国家药品标准。《国家药监局关于进一步完善药品关联审评审批和监管工作有关事宜的公告》(2019年第56号)等管理文件中也将《中国药典》的药用辅料标准列为重要参考标准。作为《中国药典》的重要组成部分之一的药用辅料标准已经成为药用辅料生产、选用、审评审批及监管的重要依据。通则0251中也指出了“《中国药典》收载的药用辅料标准是对其质量控制的基本标准”。②首选性。通则0251中规定:对于声称符合《中国药典》的药用辅料必须执行《中国药典》的相应标准正文。如经研究确认《中国药典》收载的药用辅料标准不能全部适用于某一药品的安全性、有效性及制剂的需求,或《中国药典》尚未收载某药用辅料品种或规格,在药品制剂研发和上市后变更研究中可选择适宜的药用辅料,并制定相应的内控标准。从而突出了药典药用辅料标准的强制首选性和适用性研究的必要性。③与时俱进性。通则0251中规定:《中国药典》收载的药用辅料标准应根据已上市药品中使用的药用辅料的质量特点,在充分评估的基础上,适时进行修订。着重强调了药典药用辅料标准应结合实际应用和产品技术更新而不断完善,着重挖掘药用辅料的关键质量属性,并以适宜的方式体现在《中国药典》这个载体中。
2.1.3 构建药用辅料功能性相关指标的标准体系
药品的关键质量属性可以分为安全性、有效性和质量均一性,而药用辅料除了安全性和质量均一性至关重要外,其有效性不体现在功能主治和疗效用途方面,而是体现在其在制剂中发挥的功能性方面。根据药用辅料在制剂中发挥的功能,其可分为稀释剂、黏合剂等数十种,每种功能有不同的功能性相关指标来体现或区分,这些指标又需要有一定通用性和标准化的检测方法来评价,以便使其更好的体现在有强制性的标准中。各国药典对药用辅料的功能性相关指标规范程度、表述体例等均不相同,研究建立《中国药典》药用辅料功能性相关指标标准体系对药用辅料质量控制至关重要,亦可推动药用辅料产业升级、推进国产制剂质量疗效提升。本版药典在编制过程中,结合行业发展阶段的特点和《中国药典》在监管中的地位和作用,构建了适宜的药用辅料功能性相关指标标准体系,包括以下4个层级:
①细化分类指导原则。本版药典修订了指导原则9601,该指导原则在《中国药典》2015年版首次收载,原名<药用辅料功能性研究指导原则>,介绍了药用辅料11类功能的功能性指标。本版药典对其名称进行了规范,将原“功能性指标”统一改为“功能性相关指标”,使表述更为贴切;功能类别扩展为19类;每一类中分概述、化学性质、物理性质、功能机制、功能性相关指标几部分进行详细阐述;《中国药典》中已有通用检测方法的,均在每个功能性相关指标后加注了相应通则或指导原则的编号。
②增订通用检测方法。鉴于功能性相关指标的通用检测方法对于评价药用辅料功能性至关重要,国家药典委员会一直在致力于组织相关单位对其进行研究开发。本版药典新增了相关的通用检测方法0992<固体密度>和0993<堆密度与振实密度>,后续将逐步把成熟的方法纳入《中国药典》。
③拟定编写指导原则。药用辅料功能性相关指标的评价在《中国药典》标准中主要是通过【检查】项和【标示】项体现。【检查】项通常属于必检项目;【标示】项属于必标示项目。本版药典通则0251中规定“本部正文标示项下规定应标明的内容应在产品标签、包装、质量标准或检验报告书(其中至少一个)中标明”,以便药用辅料的使用方和监管方进行识别、检验及监管;另外还规定“仅在标示项中涉及的功能性相关指标,其检测方法及限度要求应由药用辅料供需方在检验报告书或质量协议等载体中载明”,以便完善功能性相关指标标准体系并使其更具可操作性。
④拓展品种正文功能性相关指标收载。如硅酸镁铝修订了标准中的来源描述,从源头上保证其功能性的要求。又如十二烷基硫酸钠在【检查】项中增订了脂肪醇组成项,并在【标示】项规定“应标明十二醇的标示值,以及十二醇与十四醇的含量之和的标示值”。此标准表述方式既可控制一家企业生产的十二烷基硫酸钠的批间差异,也可区分不同企业生产的十二烷基硫酸钠之间组分的差异。又如本版药典通过【标示】项,新增了对部分药用辅料功能性相关指标的要求,如胶态二氧化硅增加标示比表面积;微晶纤维素增加标示产品型号、粒度分布、堆密度;白陶土增加标示吸着力和膨胀力等。
本版药典通过构建药用辅料功能性相关指标标准体系,使《中国药典》药用辅料标准更好体现药用辅料特性、控制药用辅料质量,强化了《中国药典》的指导性和可操作性,推动药用辅料功能性相关指标的深入研究,更好为仿制药一致性评价及关联审评审批提供技术支撑。
2.2 药包材的标准体系
目前,影响较大的国外药典标准体系,如美国药典(USP)、欧洲药典(EP)、日本药局方(JP)等,均已收载相关药包材标准。从其药典标准框架体系来看,其药包材系列标准更加侧重于以材料及其容器为主线的通用性标准,如玻璃、塑料、橡胶材料和/或其成品的通用要求。同时涵盖了满足通用要求评价的性能测试方法。除此之外,USP还设立了更为广泛的评价和研究指南性章节。在此基础上的标准框架体系将更加有利于具体药包材产品的标准制定。
我国药典药包材标准还在起步阶段,为了构建更加合理、完善的中国药典药包材标准体系,国家药典委员会特别设立专项课题“药包材标准体系规划和体例规范”进行研究。基于“借鉴国内外经验,立足我国国情,国家标准保基本”的总原则,初步确定《中国药典》药包材标准体系建立的思路为:
①关注基本要求:建立药包材生产使用的基本要求(通则或指导原则),规定各类药包材的安全性及其它必须的通用性基本要求。
②关注安全性评价:结合关联审评审批的需要,适时完善药包材安全性评价指导原则等。
③关注功能性评价:通过建立包括阻隔性能、密封性能、自身稳定性和使用性能等关键项目的检测方法,为确保产品功能性奠定基础。
④关注对个性化产品标准的指导:对某类药包材生产和质量控制制定基本的通用的技术要求,指导行业和企业制定个性化的产品标准。如腹透包装系统、吸入制剂包装系统等,各企业各产品有特定的一些指标和参数,个性化、定制化、保密性的特点较突出,不宜制定单一的、公开的且强制的产品标准,可通过对该类产品的通用技术要求,指导企业根据基本要求制定完善合理的产品标准。
结合药典编制大纲的要求和原则,根据现有药典标准“以凡例为总体要求、通用技术要求为基本规定、正文为具体要求”的特点,故本版药典首次收载了目前应用比较广泛、较成熟的16个通用检测方法,后续将把成熟的相关通用技术要求和通用检测方法逐步收载入药典。
3 本版药典药用辅料和药包材通用技术要求的主要特点
3.1 加强特殊药用辅料全链条质量管理
为加强对动物来源辅料、预混和共处理辅料的全链条质量管理及风险防控,本版药典首次收载了9602<动物源药用辅料指导原则>和9603<预混与共处理药用辅料质量控制指导原则>两个指导原则,均填补了《中国药典》该领域技术要求的空白。
9602<动物源药用辅料指导原则>在概述部分明确了所谓动物来源药用辅料的定义和分类,阐明了该指导原则的适用范围。后续分原材料的一般要求(包括入选标准、来源、批次、质控要求等)、生产工艺和过程控制(包括生产工艺研究、外源因子的灭活/去除等)、质量研究和稳定性研究(包括基于原材料特点和制剂特性的质量研究、稳定性研究与贮藏要求等)和供应商审计(对辅料供应商的审计、对辅料原材料供应商的审计等)详述了该类药用辅料的质控关键点及注意事项。
9603<预混与共处理药用辅料质量控制指导原则>全面梳理了预混辅料和共处理辅料这两类加工较为特殊的药用辅料,其在生产过程管理和质量标准建立方面的关键点,包括概述(定义、分类、适用范围等)、生产工艺和过程控制、质量控制(性状、鉴别、检查、功能性指标、含量及功能有效性指标、微生物限度、稳定性研究)等内容。
3.2 加强药包材通用检测方法的规范
3.2.1 玻璃容器相关测试方法
4001<121 ℃玻璃颗粒耐水性测定法>明确了定义和仪器装置中玻璃容器的材质种类;规范了本标准中指示剂的描述,说明与药典现行的甲基红指示剂的区别;强调了本试验中试验用水的特殊要求,应不含有重金属,不含溶解性气体。
4003<玻璃内应力测定法>完善了内应力概念,细化了检测原理,明确了检测目的,同时在测定法中区分为无色供试品和有色供试品的测定。
4006<内表面耐水性测定法>明确了定义和测试原理,并在测定法中给出了灌装体积的测定方法及精度要求,明确了灭菌器的升降温及控温精度要求。
4009<三氧化二硼测定法> 明确了原理和检测目的,测定法中除采用铂坩埚外,补充完善了镍坩埚的使用方法,细化了操作,更利于检验人员应用。
3.2.2 阻隔性能相关测试方法
阻隔性能是影响产品在货架期内质量的重要因素,也是确定货架期的重要参考指标,通过检测能避免药品由于对氧气或水蒸气敏感而产生的氧化变质、受潮霉变等问题。可用于控制包装物的通透性、保障药品在存储期内安全有效、指导选择合适的包装材料[2]。本版药典收录了4007<气体透过量测定法>和4010<水蒸气透过量测定法>两个测定方法。
4007<气体透过量测定法>保留两项测定方法:第一法压差法和第二法电量分析法。具体内容按方法适用范围、仪器装置、测定法的顺序进行编写。
4010<水蒸气透过量测定法>主要收载三种测定方法:第一法重量法,根据原理进行整合和梳理,按原理分为增重法和减重法,增重法中细分杯式法和容器法;第二法电解分析法;第三法红外检测器法。将具体内容按方法名称、测定原理、仪器装置、测定法、附注的顺序进行编写。
3.2.3 物理机械性能测试方法
物理机械性能是衡量药品包装在生产、运输、货架期、使用等环节对内容物实施保护的基础指标,一般包括:拉伸强度与伸长率、热合强度、剥离强度、热收缩性、穿刺力、穿刺器保持性、插入点不渗透性、注药点密封性、悬挂力等。本版药典收载了4004<剥离强度测定法>、4005<拉伸性能测定法>、4008<热合强度测定法>、4015<注射剂用胶塞、垫片穿刺力测定法>、4016<注射剂用胶塞、垫片穿刺落屑测定法>五个测定方法。
4004<剥离强度测定法>、4005<拉伸性能测定法>、4008<热合强度测定法>均属于材料的功能性指标。方法均明确了定义和适用范围,后续按仪器装置、试验环境、试样制备、测定法和结果判定阐述,由于材料的特性受环境的影响很大,在本处特别说明了样品的放置条件和试验条件。
4015<注射剂用胶塞、垫片穿刺力测定法>和4016<注射剂用胶塞、垫片穿刺落屑测定法>均明确定义和适用范围,为了更好地使用方法进行检测,将方法细分了三种,前两种是针对胶塞,按应用的注射剂装量进行区分,以50 mL为界;第三法是针对垫片。
3.2.4 生物安全性能测试方法
为加强药包材的生物安全性评估,本版药典收载了4011<药包材急性全身毒性检查法>、4013<药包材溶血检查法>和4014<药包材细胞毒性检查法>三个测定方法。
4011<药包材急性全身毒性检查法>从方法定义、试验用小鼠规定、供试品溶液和对照液制备、检查法和结果判定方面对方法进行了详细的说明。如在供试品溶液制备中推荐了4种浸提条件,方便操作者选择适宜的条件进行试验。
4013<药包材溶血检查法>首先明确了定义,后续从试验前准备(即新鲜抗凝兔血的制备)、供试品制备、检查法和结果计算来描述。推荐了两种常见的抗凝剂供操作者选择。
4014<药包材细胞毒性检查法>收载了四种方法,即第一法相对增殖度法、第二法琼脂扩散法、第三法直接接触法和第四法浸提法。分别从阴性、阳性对照液制备,检查法和结果评价方面进行阐述。其中细化了很多内容,更有利于方法的选择和使用,如推荐了供试品溶液制备的浸提比例和浸提条件、阳性对照制备中的生物毒性阳性参比物质、明确了毒性分级划分等内容。
4 展望
我国医药产业已从满足基本需求过渡到谋求高质量发展阶段。众所周知“一流的企业做标准、二流的企业做品牌、三流的企业做产品”,而我国的药用辅料和药包材产业从产品的可及性、多元化、精细化、功能化、定制化等方面总体而言尚有较大的提升空间,参与国家标准、国际标准制定的硬实力和积极性均不够高。《中国药典》作为国家标准的法典,有义务、有意愿致力于强化“以标准促进技术创新,以技术带动标准进步”的共生效应。
《中国药典》2020年版的颁布不是终点,而是新起点,后续国家药典委员会将继续带动全行业,共同加强药用辅料和药包材标准体系的不断完善,助力我国药品质量与疗效的提升,保障公众用药安全有效,以标准推动国家治理现代化。
致谢:第十一届国家药典委员会药用辅料与药包材专业委员会全体委员和特邀专家;承担国家药典委员会药用辅料和药包材标准提高课题的各单位及相关企业、协会;中国医药包装协会
参考文献
[1] 洪小栩,许华玉,尚悦,等.《中国药典》2015年版四部增修订概况[J].中国药品标准,2015,16(5):326
HONGXX, XU HY, SHANG Y, et al. Explanation on Chinese Pharmacopoeia 2015 edition Volume Ⅳ[J].Drug Stand China, 2015, 16(5):326
[2] 方旻,谢新艺.高分子材料的阻隔性能及在药包材上的应用[J]. 广州化工,2011,39(16):38
FANG M, XIE XY. Barrier Properties of polymer materials and its application in drug packaging [J].Guangzhou Chem Ind, 2011, 39(16):38
(收稿日期:2020-07-06)