协会服务热线
010-6226-7180
新的登记与审评审批制度下,药包材企业若能迅速完成登记,在开发新客户上无疑有巨大优势,公告平台上可供制剂企业选用的公示信息也是最好不过的广告,这是巨大的机遇;而如何维持一个有效运行并且能满足法规要求和客户要求的生产质量管理体系,则是药包材生产企业面临的最大挑战。
关注包材审评方式变化带来的影响.


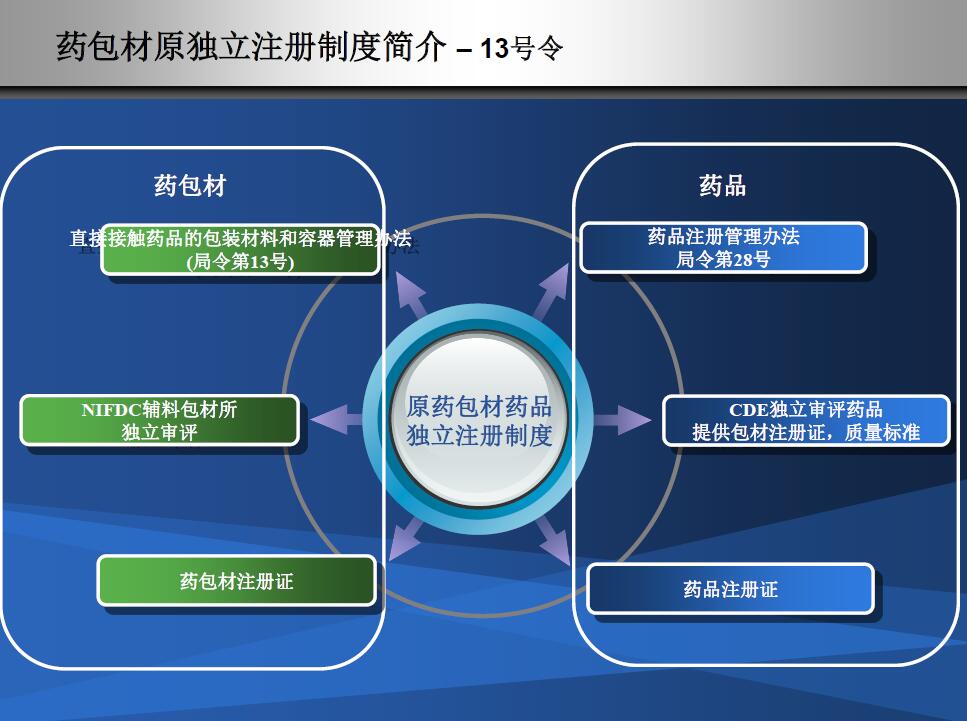

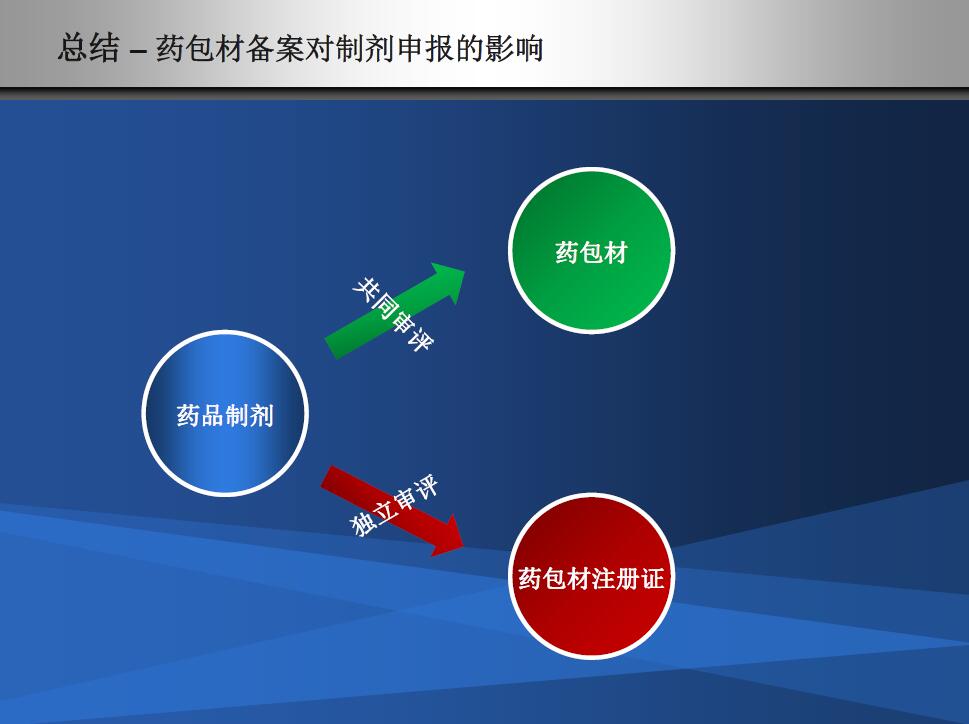
独立审批

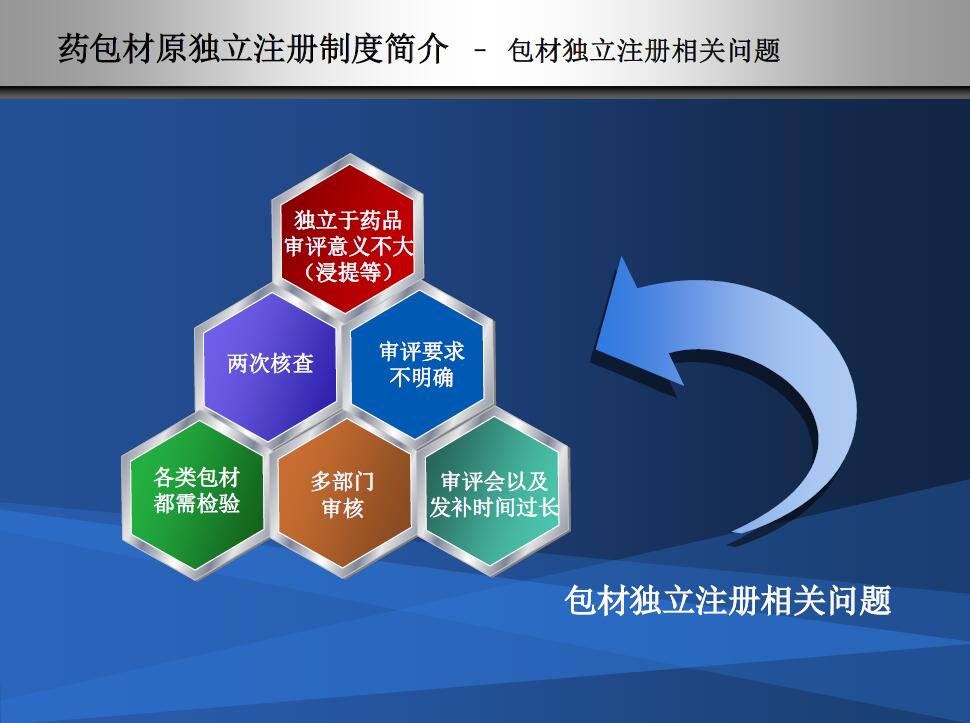
相关问题,有问题才有变化,变化才能更好

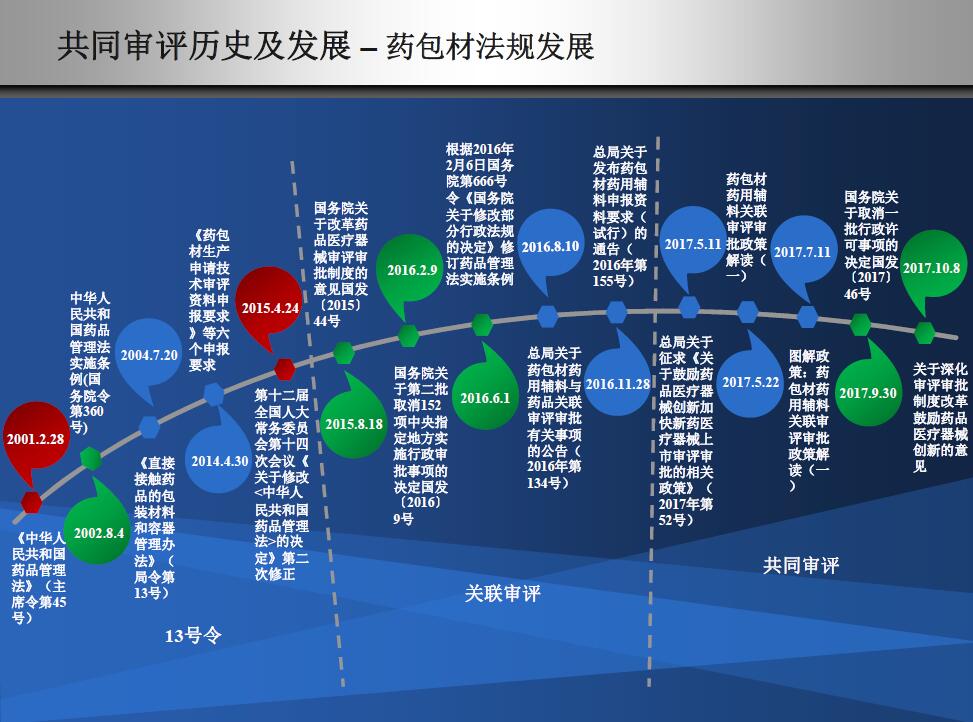
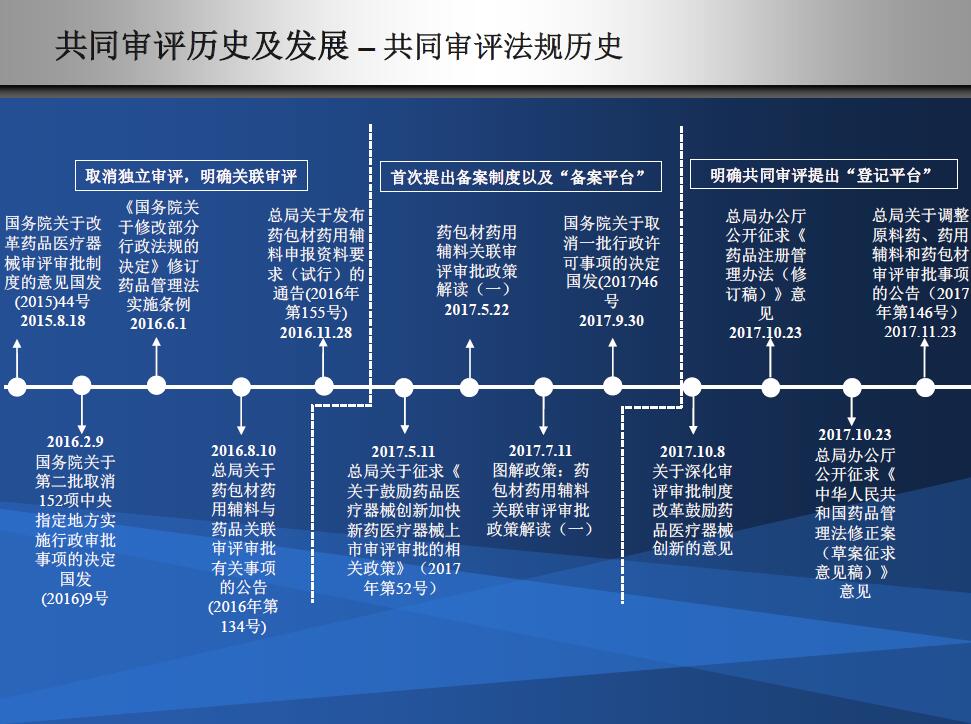
发展历程
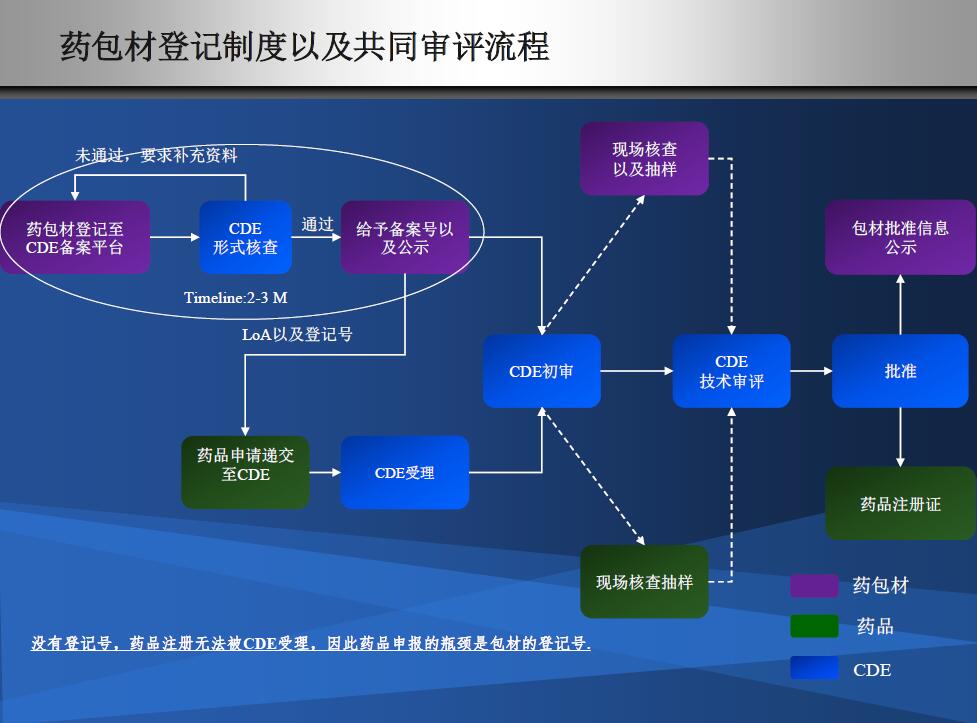
看看注册资料变了吗?


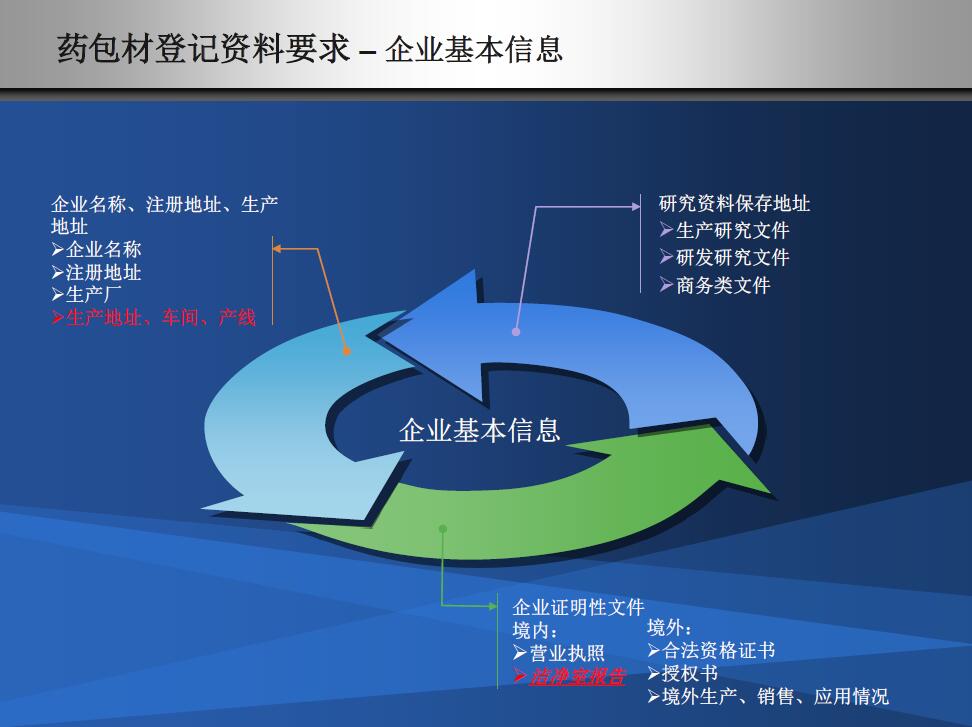
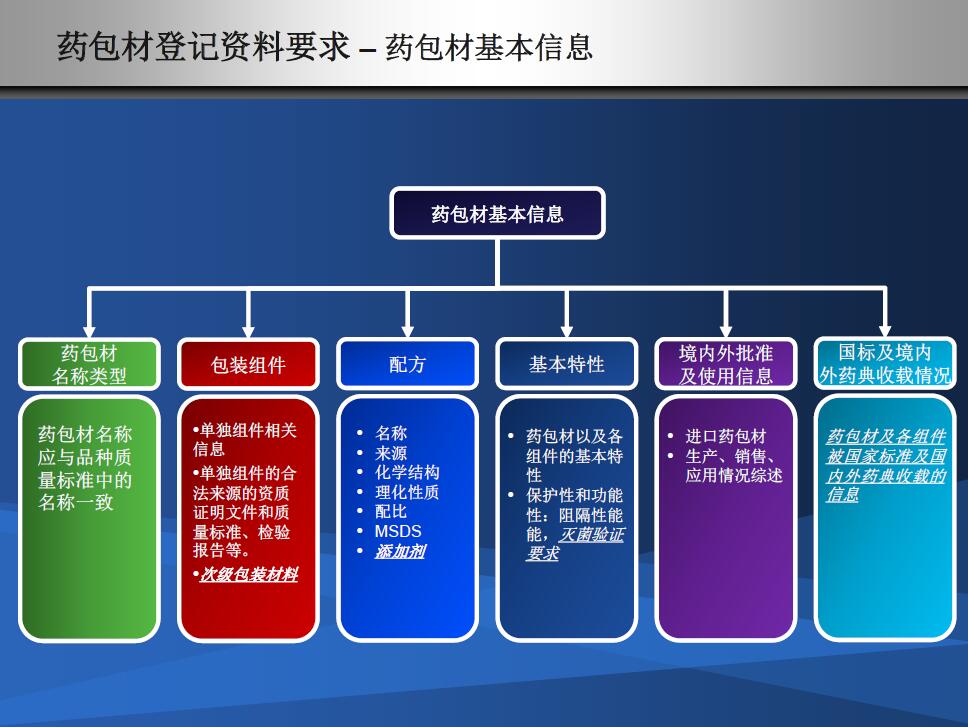
资料基本信息
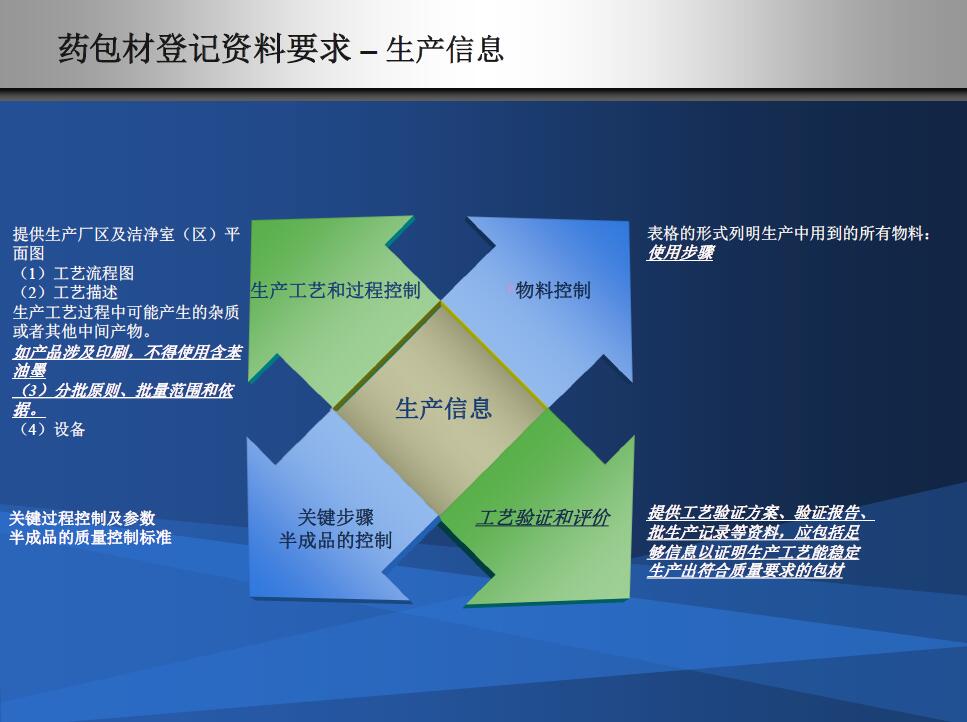
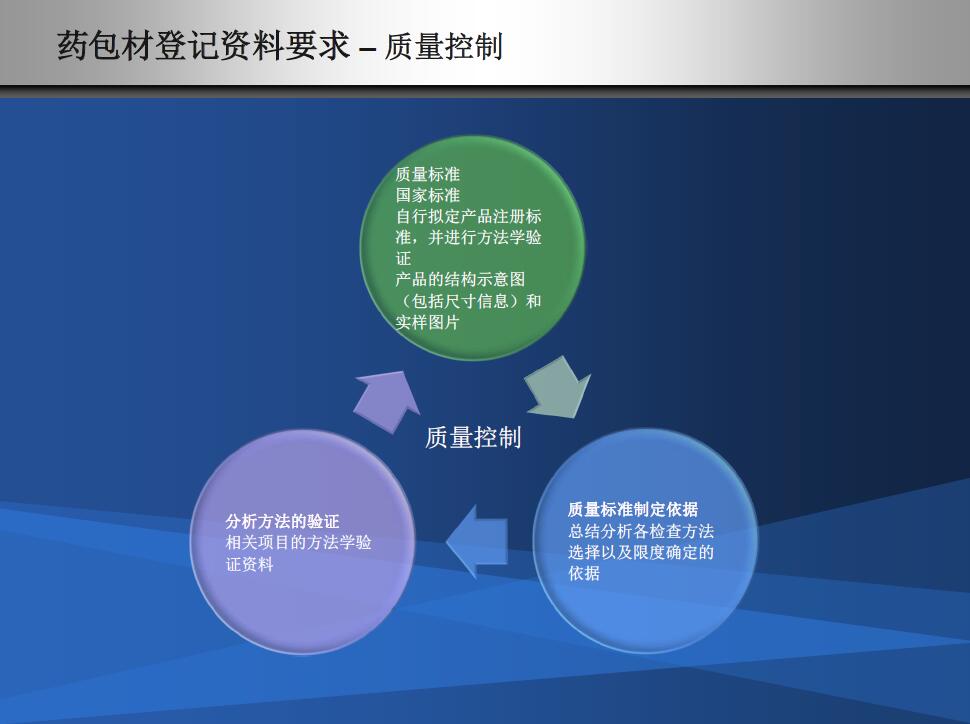



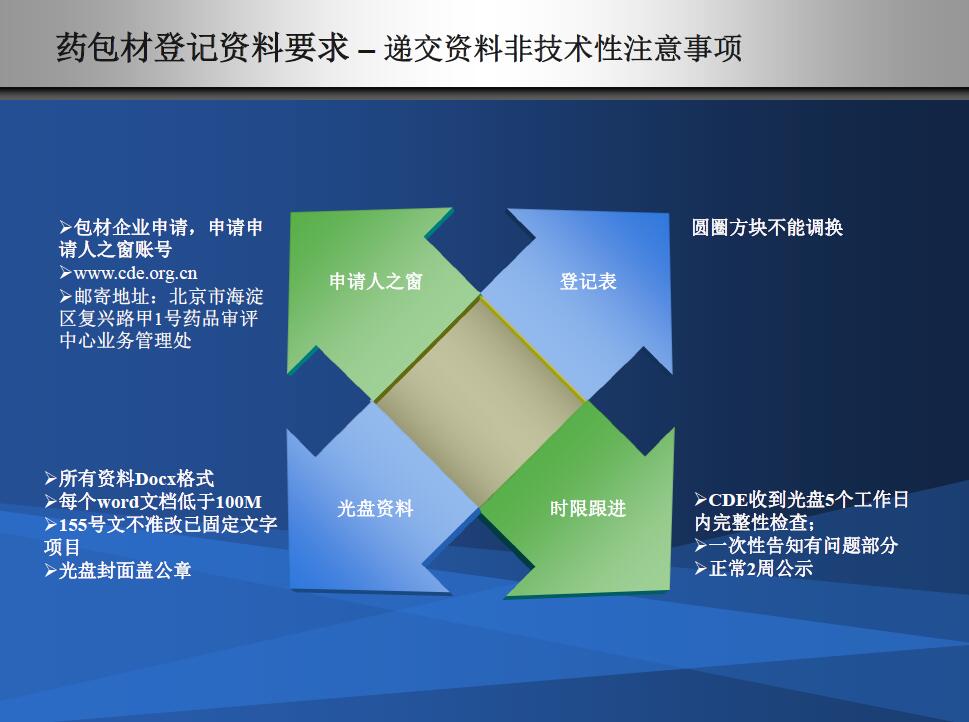
递交材料注意细节



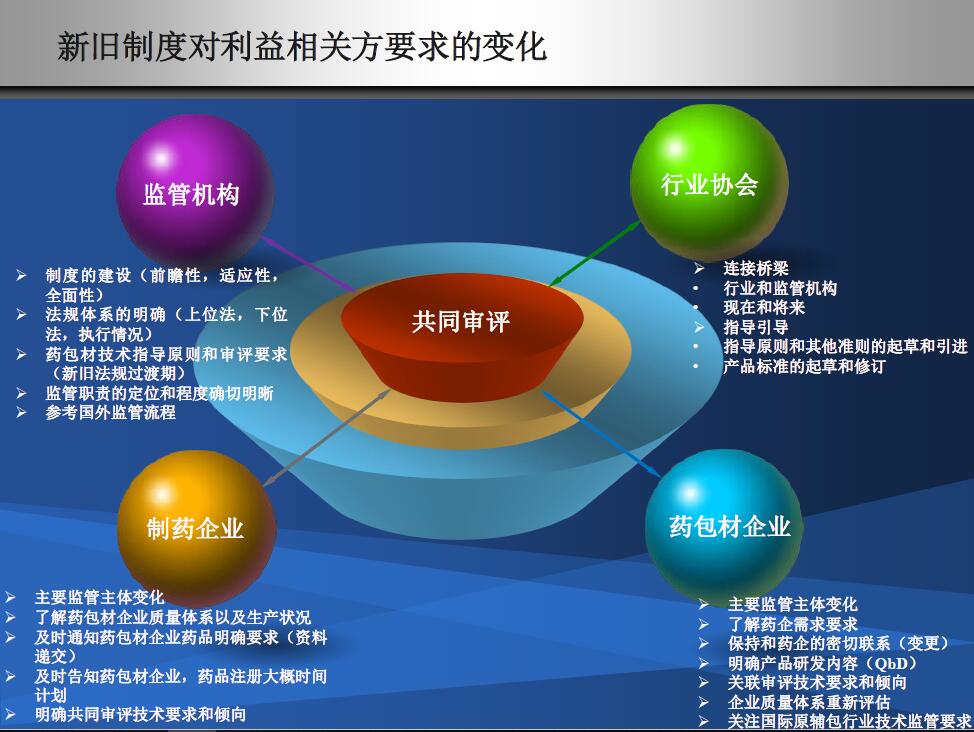
一定要识别独立到共同这个变化带来的利益相关方影响

还没有正式文件,只有征求意见进行讨论了

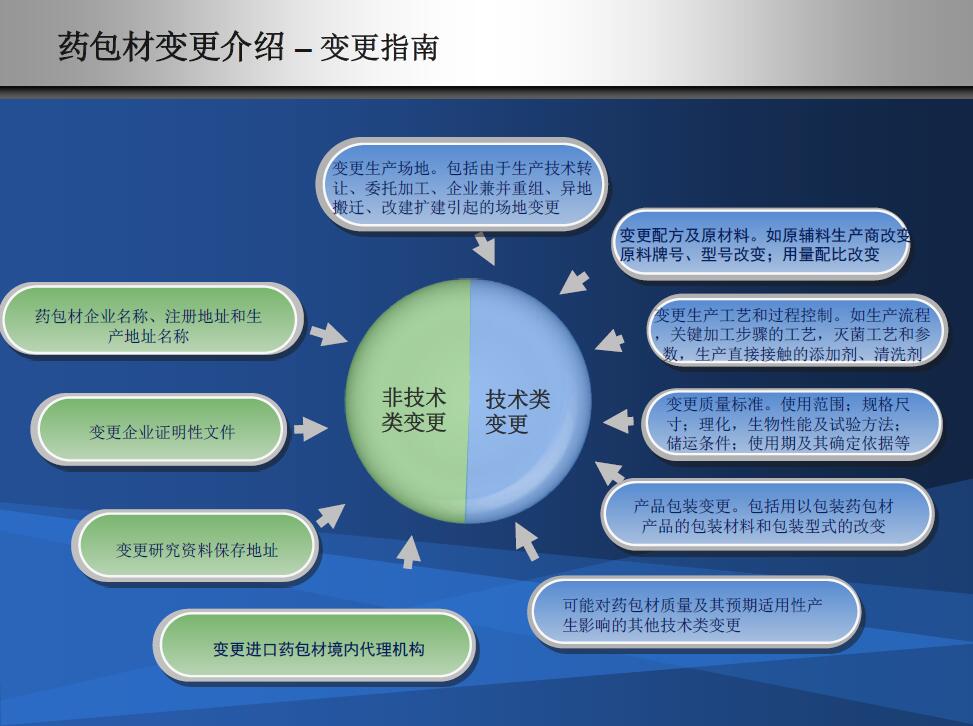
包材变更对于制剂的影响如何评估,需要提前讨论
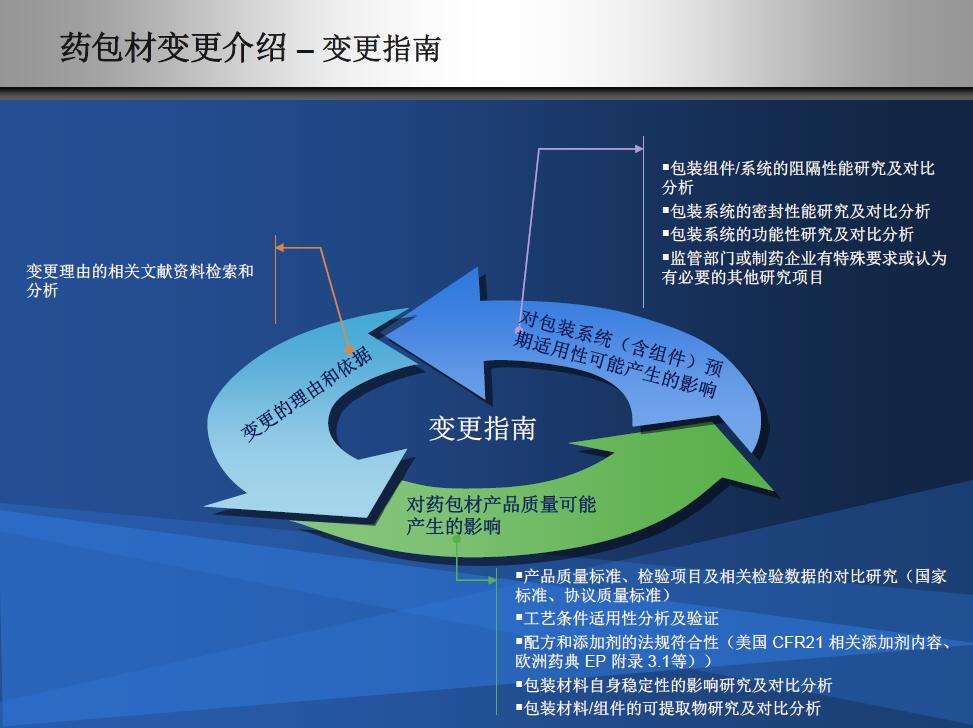
包材供应商的不同种类变更是不是药品制剂厂家的同类变更?显然不是
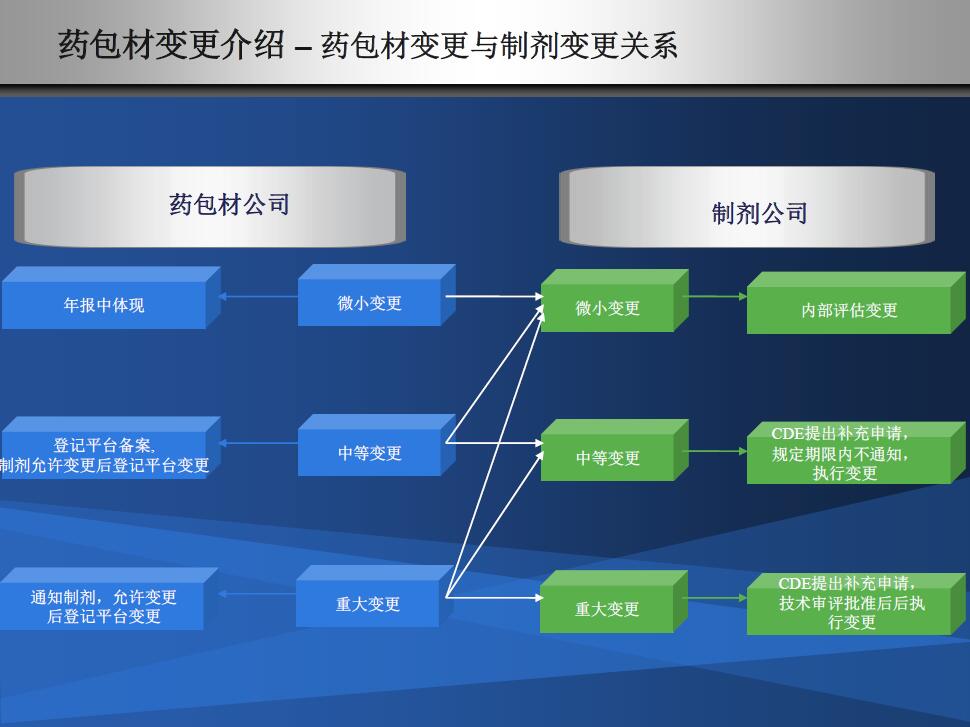
目前包材拿一个登记号也就二个月,快的话两周。可是真正的审评开始于药品审评。
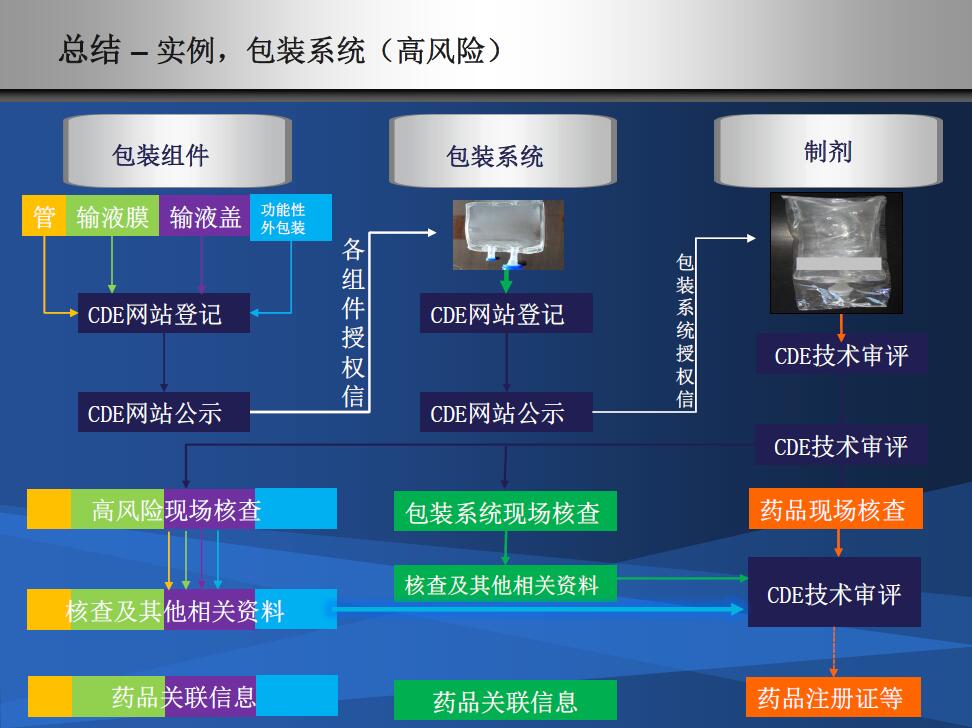
不同颜色代表了不同组件;如何和组件厂商开展有效合作至关重要

相关问题:
1. 关于进口产品涉及的进口包材在欧美并不是强制要求DMF的,但是国内在目前还是要求的,会增加进口药品进了的难度。
2. 提交的电子文件要word版,不加密,可是如何保证信息安全?可以copy , paste就完成了,如何防止修改?
3. 对于生物产品的DS物料,和成品一样;但容器不同,是不是也要进行相容性测试?没有明确
4. 对于老的现有包材,是补充信息,还是重新审请一个登记号?大家倾向重新申请
5. 谁来进行现场检查?
共同审评迈出巨大一步,但还有很多细节需要审评和企业来探索!
* 阅读原文请点击: https://www.meipian.cn/1b0mot3c?share_depth=3