协会服务热线
010-6226-7180

今年1月12日,国家药品监督管理局就《关于药械组合产品注册有关事宜的通告(修订草案公开征求意见稿)》公开征求意见,以进一步加强药械组合产品注册管理。
今年8月25日,“2021姑苏对话” 将在苏州开设 “良好风险管理下的药械组合产品” 主题论坛,邀请业界同仁坐而论道,多角度探讨国内外法规对药械组合产品的合规要求。
近年来,随着科学技术的发展,越来越多的药械组合产品进入大家视野。基于药械组合产品的属性界定及相关风险问题,国家药监部门对该类产品的监管力度也在不断加大。
早在2009年11月,国家药监部门发布《关于药械组合产品注册有关事宜的通告》,明确了药械组合申报、审评等内容。但随着医药行业的快速发展,以及《药品管理法》《医疗器械监督管理条例》及配套规章的修订和实施,原通告已不能完全适应现行法律法规和行业发展的需要。
《关于药械组合产品注册有关事宜的通告(修订草案公开征求意见稿)》意味着距离新法规的出台已经不远了。
你或你的客户存在药械组合产品研发上市问题吗?
你知道我国药械组合产品属性界定工作现状及申报途径吗?
你想知道别的企业是如何在风险管理下做药械组合产品相容性研究的吗?
你想知道EU GMP附录1《无菌产品生产》的变化,以及FDA对CDER/CDRH主导组合产品检查(7356.000)的要求吗?
还有生物制药过程的污染风险分析和污染控制策略、灭菌包装和无菌转移解决方案在制药领域的应用,你想了解详细情况吗?
那还犹豫什么?来吧!来“2021姑苏对话”,你想要的答案就在这里——2021年8月26日,“良好风险管理下的药械组合产品”分论坛,不见不散!
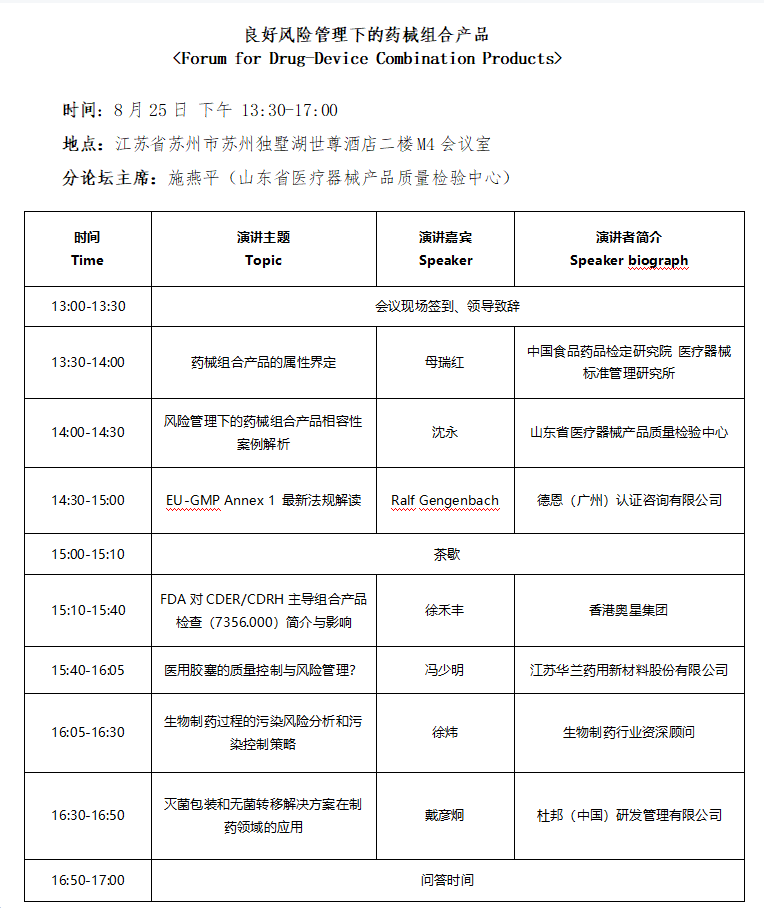
注:最终日程安排以现场为准。
“2021姑苏对话”相关安排:
时 间丨8月25日-27日
地 点丨苏州独墅湖世尊酒店
联 系 人丨郭珣 010-62267180-8008 guoxun@cnppa.org
杨红 010-62267180-8009 yanghong@cnppa.org